Как получают низкие температуры
Никто точно не знает, когда люди
научились добывать огонь и искус-
ственно нагревать тела до температуры
Страница переведена на новый сайт https://myeducation.su/ : страница
ФИЗИКО-МАТЕМАТИЧЕСКИЙ ЖУРНАЛ Квант (1 1972)
выше окружающей среды. Во всяком
случае, это случилось десятки ты-
сяч лет тому назад, в эпоху, извест-
ную под названием каменного века.
А вот дата получения искусствен-
ного холода известна довольно точно.
Будем условно считать, что низкие
температуры — это температуры ниже
тех, что естественным образом воз-
никают при изменении погоды. Впер-
вые такую низкую температуру
A63° К, или — 110°Х) получил Фа-
радей в 1840 году. Это много холод-
нее самых лютых холодов Антарк-
тиды (наинизшая зарегистрированная
температура в Антарктиде — около
—90-С).
Почему же искусственно созда-
вать высокие температуры люди уме-
ют с незапамятных времен, а искус-
ственный холод им удалось создать
лишь совсем недавно?
С одной стороны, это связано с
тем, что в высоких температурах лю-
ди больше нуждались, чем в низких.
С другой стороны, возможной при-
чиной «отставания» техники получе-
ния низких температур является то
обстоятельство, что высокие (но не
слишком) температуры получать не-
сравненно проще, чем низкие. В са-
мом деле, достаточно чиркнуть спич-
кой, чтобы получить температуру вчет-
веро более высокую, чем комнатная.
А Фарадею для того, чтобы получить
температуру только вдвое ниже ком-
п
натной, понадобилось создать далеко
не простое устройство.
Это «неравноправие» способов по-
лучения высоких и низких темпе-
ратур не случайно. В нем находит
отражение один из основных законов
природы, так называемый второй
закон термодинамики (напом-
ним, что первый закон термодинами-
ки— это закон сохранения энергии).
На первый взгляд кажется, что
охладить какое-нибудь тело очень
просто: нужно это тело привести в
контакт с другим телом более низ-
кой температуры. Тогда от охлаж-
даемого тела к холодному само собой
будет переходить тепло, что и при-
ведет к требуемому охлаждению; если
есть лед, то нетрудно сделать и мо-
роженое!
Но как быть, если тело нужно
охладить до такой низкой темпера-
туры, что подходящего другого хо-
лодного тела, к которому само собой
могло бы переходить тепло, не су-
ществует? Тогда, очевидно, такое
холодное тело, или, как говорят,
хладоагент нужно создать ис-
кусственно. Вот в этом и состоит за-
дача техники получения холода. Од-
нако при изготовлении хладоагента
тоже необходимо обеспечить тепло-
отдачу от него к какому-то другому
телу, но не более холодному, пото-
му что такого тела нет, а более теп-
лому, например, окружающей среде
(воздуху, воде и т. и).
Прежде всего выясним, какая в
этом таится трудность.
12 Низкие температуры.
Порядок и беспорядок в веществе
Вспомним, что температура тела
определяется энергией беспорядоч-
ного теплового движения его ато-
мов и молекул. Понизить температу-
ру — значит уменьшить беспорядок,
царящий среди молекул.
Что же такое беспорядок? Если
каждый предмет в вашей квартире
всегда находится на определенном
закрепленном за ним месте и найти
его всегда легко, то вы поддерживаете
в своей квартире порядок. Если же
вещи кладутся куда попало, то найти
их нелегко. В вашей квартире бес-
порядок.
Чем больше размеры вашей квар-
тиры, тем больше времени вам по-
требуется для того, чтобы отыскать
ту или иную вещь, если вещи равно-
мерно разбросаны, — тем больший
беспорядок в вашей квартире. Пред-
ставьте себе, что вещи в комнате мо-
гут сами двигаться, меняя свое по-
ложение. Тогда найти их станет еще
труднее, причем тем труднее, чем
больше скорости их движения.
Этот житейский пример помогает
нам понять, как определить, что та-
кое порядок м беспорядок в моле-
кулярном мире. Степень беспо-
рядка оп реде л яетс я» веро я т-
н остью обнаружить молеку-
лу (и л и другую частицу) в
к а к о м-н ибудь определен-
ном состоянии, например, в
определенной точке прост-
ранства.
Если имеется заданное количество
частиц, равномерно распределенных
в данном объеме, то вероятность об-
наружения частицы в данной точке
будет тем больше, чем медленнее
движутся частицы, чем медленнее они
меняют свое положение в заданном
объеме. Но скорости молекул опре-
деляются температурой тела. Поэто-
му чем выше температура тела, тем
больше степень беспорядка среди мо-
лекул, из которых оно состоит. Из
предыдущего ясно также, что сте-
пень молекулярного беспорядка тем
больше, чем больше объем, предо-
ставленный частицам.
Таким образом, степень беспоряд-
ка зависит от двух факторов — от
температуры тела и от его
объема. Увеличение температуры
при заданном объеме, так же как и
увеличение объема при постоянной
температуре, приводит к увеличению
степени беспорядка среди молекул.
Оказывается, все процессы, ко-
торые происходят в природе, в замк-
нутой предоставленной себе системе
(то есть в системе, состоящей из час-
стиц, взаимодействующих друг с дру-
гом, но не с другими телами), про-
ходят так, что степень беспорядка
возрастает. И когда эта степень бе-
спорядка достигает самого высокого
значения, все процессы сами собой
прекращаются. Наступает состояние,
которое называется состоянием рав-
новесия.
Представьте себе шарики двух
цветов, расположенные в определен-
ном порядке. Нужны были немалые
старания, чтобы расположить ша-
рики в правильной последователь-
ности. Но достаточно легкого толч-
ка, чтобы с трудом созданный порядок
нарушился и шарики беспорядочно
перемешались. И никакими толч-
ками восстановить исходный порядок
невозможно. Вероятность такого со-
бытия ничтожно мала.
А вот пример уже из атомно-мо-
лекулярного мира. Бросив кусок са-
хара в воду, мы легко получим ра-
створ, в котором молекулы сахара
распределены по всему объему сосу-
да. Но сколько бы мы ни ждали, ра-
створ никогда сам собой не разде-
лится на воду и сахар. Для того чтобы
получить сахар и воду отдельно,
нужно затратить определенную энер-
гию, нагрев раствор и испарив воду.
Физический смысл второго закона
термодинамики и заключается в ут-
верждении, что порядок и беспорядок
в природе «неравноправны», что все
сами собой идущие процессы уста-
новления равновесия сопровожда-
ются ростом беспорядка. В нем и кро-
ется причина того, что высокие
13 Низкие температуры.
температуры легче получать, чем низ-
кие. При увеличении температуры тела
(при сохранении его объема) увели-
чивается беспорядок. Охлаждать же
тела — значит увеличивать порядок,
то есть действовать, так сказать,
«против природы».
Тем не менее охлаждать тела,
оказывается, все-таки можно. Можно,
следовательно, заставить тепло пе-
реходить не от теплого тела к холод-
ному, а, напротив, от охлаждаемого
тела к телам более теплым. Таким
образом создают хладоагенты.
Беспорядок — физическая величина
Огова «порядок» и «беспорядок»,
которыми мы здесь пользовались, ка-
жутся на первый взгляд какими-то
ненаучными, взятыми из повседнев-
ной жизни. В действительности за
этими словами скрывается физиче-
ское понятие настолько важное, что
оно выражается специальной вели-
чиной. Эта величина, выражающая
степень беспорядка или порядка (го-
рядок — это просто отсутствие бес-
порядка), называется э н т р о п и —
е й. Обозначают ее буквой S, а оп-
ределяется она так: если к телу под-
водится или от него отводится неко-
торое количество тепла AQ, а аб-
солютная температура тела при этом
равна 7\ то изменение энтропии
A определяется равенством
Во всех процессах, которые проис-
ходят с телами, важна не энтропия,
а именно изменение энтропии. (В
этом отношении энтропия похожа на
потенциальную энергию тела. Во всех
задачах важна не сама потенциальная
энергия, а ее изменение.)
Особый интерес представляет для
нас случай, когда процесс происходит
так, что к телу не подводится и от
него не отводится тепло: AQ=0. Такие
условия можно обеспечить хорошей
теплоизоляцией тела или быстрым
проведением процесса, когда тепло
не успевает перейти от одного тела к
другому. Называются такие процессы
адиабатными. Из выражения
AS = ~- следует, что при адиабат-
ных процессах энтропия не меняется.
Адиабатное изменение объема
В технике искусственного полу-
чения холода нас интересуют глав-
ным образом процессы изменения объ-
ема тел, процессы их расширения и
сжатия. Именно они играют здесь
особенно важную роль.
Представим себе, что у нас имеется
тело, которое мы расширяем или сжи-
маем адиабагно, то есть без под-
вода или отвода тепла. Мы уже знаем,
что увеличение объема тела с данным
количеством- частиц приводит к уве-
личению степени беспорядка, то есть
к увеличению энтропии. Но наш про-
цесс адиабатный, при котором
Дф=0 и энтропия не меняется. Как
же обеспечить постоянство энтропии
при условии, что она возрастает бла-
годаря увеличению объема? Если вто-
рое начало термодинамики правильно,
то это возможно только в том слу-
чае, если при изменении объема
тела происходит еще какой-то про-
цесс, благодаря которому энтро-
пия уменьшается ровно на столько же,
на сколько она увеличивается из-за
увеличения объема. Мы знаем, что
энтропия изменяется при изменении
температуры тела. Поэтому можно
ожидать, что при адиабатном уве-
личении объема тела его температура
будет уменьшаться. Так и происхо-
дит в действительности.
Таким образом, мы сразу получаем
способ понижения температуры тела.
Нужно данное тело адиабатно
расширить, то есть увеличить его
объем. Адиабатное расширение
как раз и является одним из главных
способов получения холода.
Одной из разновидностей расши-
рения является испарение жидкости.
Еще древние египтяне хранили на-
питки в пористых сосудах. Поры уве-
личивают поверхность испаряющейся
жидкости и тем самым увеличивают
14 Низкие температуры.
скорость ее испарения. Испарение
же приводит к охлаждению жидкости.
Плохая теплопроводность материала
стенок и большая скорость испарения
обеспечивали адиабатность про-
цесса испарения.
Таким образом, вопрос о способах
искусственного охлаждения сводится к
вопросу о том, что расширять и как
расширять.
Что расширять?
Ясно, что твердые тела для расши-
рения непригодны — они не могут
сколько-нибудь заметно изменять свой
объем. По тем же причинам непри-
годны и жидкости. Хотя увеличение
объема жидкостей при их испарении
и используется для их охлажде-
ния, особенно низкие температуры
гаким образом получить нельзя, по-
тому что, охлаждаясь, жидкость не-
пременно в конце концов отвердевает.
Так что наинизшая температура, ко-
торую можно получить при испарении
жидкости, это температура ее отвер-
девания. А для веществ, жидких
при комнатной температуре, темпе-
ратуры отвердевания не так уж низки.
Лучше всего использовать газы.
Газы способны к неограниченному
расширению, а если они к тому же
предварительно сжаты до высокого
давления, то и масса их достаточно
велика и потому достаточно велика
и теплоемкость этого газа. Для га-
зов характерен и наибольший бес-
порядок в движении частиц. А так
как наша задача — уменьшить бес-
порядок, то ясно, что лучше на-
чинать с такого вещества, у которого
беспорядок велик, чтобы было что
уменьшать!
Итак, наиболее подходящим ве-
ществом для нашей задачи является
газ. С другой стороны, конечный про-
дукт, то есть готовый хладоагент,
лучше всего иметь в виде жидкости:
жидкость всегда создает хороший теп-
ловой контакт с погруженным в нее
телом. Поэтому техника низких тем-
ператур часто (но не исключитель-
но) сводится к сжижению того или ино-
го газа.
Как известно, в жидкость может
быть превращен любой газ. Но для
каждого газа существует определен-
ная температура, называемая кри-
тической температурой
Th, выше которой он не может быть
обращен в жидкое состояние. Чтобы
газ мог быть сжижен, его температура
должна быть ниже Th. Тогда для сжи-
жения его нужно только сжать. А
насколько сжать — это зависит от
того, насколько его температура ни-
же Th: чем она ниже, тем меньшее дав-
ление нужно для сжижения. Можно
охладить газ настолько, чтобы он стал
жидким при давлении в 1 атмосферу.
Для получения умеренного холода
используются газы с высокими значе-
ниями Тн. Часто применяется, на-
пример, аммиак, у которого Тк = —
= 132,4° С. В последнее время все
шире используются так называемые
фреоны — газы, получающиеся из уг-
леводородов путем замещения в них
водорода фтором, хлором или бромом.
В домашних холодильниках, в ча-
стности, используется фреон-12
(CF2C12), у которого Г„ = П2,04″С.
Самые же низкие температуры по-
лучают сжижением газов, критиче-
ские температуры которых много ни-
же комнатной. К ним относятся:
кислород, у которого 7\= — 118,4° С,
азот с Тк——146,9°С, водород с
Th=— 239,9° С, и, наконец, гелий с
самой лизкой критической температу-
рой в природе. У него Th——267,91° С.
Сжижать эти газы не так-то про-
сто. Для этого их надо очень сильно
охладить.
Как расширять?
Расширять газ можно по-разному.
Наиболее «популярны» и чаще всего
применяются два способа расширения.
Способ первый. Расширять
лучше всего сжатый газ. Поэтому
при любом способе расширения на-
чинают с того, что газ сжимают при
помощи специальной машины — ком-
прессора— до давлений в десятки,
а иногда и в сотни атмосфер. При этом
газ нагревается по той же причине,
15 Низкие температуры.
по которой он охлаждается при рас-
ширении. Чтобы избежать нагрева
газа (какой же смысл греть то, что
нужно охлаждать?), газ после сжа-
тия охлаждают проточной водой, ко-
торой и передастся выделяющееся при
сжатии тепло. Таким образом при
сжатии обеспечивается постоянство
температуры. На рисунке 1 показана
схема установки для охлаждения по
первому способу. Компрессор обоз-
начен буквой К, а буквой Т обозна-
чен теплообменник, в котором сжатый
газ проходит через змеевик, омываемый
проточной водой. Здесь газ восста-
навливает свою первоначальную тем-
пературу. После этого он поступает
в детандер Л, который представляет
собой простой поршневой двигатель.
Здесь газ, толкая поршень, расши-
ряется адпабатио, совершая при
этом механическую работу. Охлаж-
дается он именно потому, что совер-
шает работу- Ведь при адиабатном
процессе расширения, когда тепло из-
вне не подводится, работа может со-
вершаться только за счет уменьшения
кинетической энергии молекул газа.
После охлаждения в детандере
газ попадает в холодильную камеру
Л’, где он используется для охлажде-
ния любых пометенных в нее тел.
Рис. 1.
Отнимая у них тепло, газ нагревается
и возвращается в компрессор, чтобы
пройти весь цикл снова.
.Мы видим, что действие установки
сводится к тому, что газ отнимает
тепло от охлаждаемых в холодильной
камере тел и передает тепло воде в
теплообменнике Т. Осуществляется,
таким образом, передача тепла от хо-
лодного к теплому, то есть то, что
«естественным» образом никогда не
происходит. За это нарушение «есте-
ственного» хода вещей приходится,
однако, «платить», и «платой» служит
работа, совершаемая компрессором.
Детандерный способ отличается вы-
соким эффектом охлаждения, по у не-
го есть недостатки. Во-первых, это
необходимость смазки и детандере,
что при очень низких температурах
создает некоторые трудности. Во-
вторых, этот способ дейстиует тем ху-
же, чем ниже температура. Наконец,
в детандере неудобно доводить ох-
лаждение до сжижения. По этим при-
чинам детандерный способ часто при-
меняют в комбинации с другим спо-
собом расширения.
Способ второй. Этот спо-
соб расширения отличается тем. что
эффективность его с понижением тем-
пературы растет, так что он особен-
но удобен для получения самых низ-
ких температур.
В отличие от первого способа,
здесь газ после компрессора К и теп-
лообменника Т (рис. 2) направляется
прямо к холодильной камере, нп по-
падает туда через особый кран, на-
швасмый дросселем. Устроен дрос-
сель так, что в нем гасится скорость
газового потока (слово «дроссель» оз-
начает именно эту его особенность)
и газ проходит через него настолько
медленно, что давление как перед
дросселем, гак и после пего остается
все время постоянным: до дросселя
оно такое, какое создается компрессо-
ром, а после дросселя оно равно, на-
пример, одной атмосфере.
Проходя через дроссель, газ не
совершает работы — он не толкает
поршень, не вращает турбину. Тем не
менее, адиабатное расширение при
16 Низкие температуры.
дросселировании привили г к охлажде-
шно газа. Объясняется это тем, что
молекулы газа взаимодействуют меж-
ду собой. Когда при расширении газа
молекулы удаляются друг от друга,
производится работа против молеку-
лярных сил, связывающих молеку-
лы, м кинетическая энергия молекул.
а. значит, и температура газа, пони-
жается. Можно скачать, что и здесь
совершается работа, по не против
внешних сил, как в детандере, а про-
тив внутренних сил сиеплепия между
молекулами.
Эффект охлаждения газа при дрос-
селировании называется эффектом
Джоуля — Томсоиа.
Для эффекта Джоуля Томсоиа
важно, что гаи не идеален, то есть его
молекулы взаимодействуют друг с
другом на расстоянии, а не только при
непосредственном «ломовом» столкно-
вении. Идеальный газ при дросее-
лироняйпи не охлаждался бы. Его
можно было бы охладить, только
используя Детандер
Как уже укалывалось, охлаждение
при дросселировании тем сильнее,
¦/ем ниже температура. Пом комнат-
поп температуре, с которой приходит-
ся начинать, оно невелико. Для того
чтобы, несмотря па это. достигнуть
значительного охлаждения, прибе-
гают к остроумному приему, сущность
которого ясна пз рисунка 2.
Труба, по которой сжатый га.»
поступаог к дросселю, помещена в
другую, более мшрокую трубу. Когда
после дросселирования газ слегка
охладится, он возвращается из xv
лощлыюн камеры к компрессору по
inipoKOii трубе, охлаждая «по до-
роге» встречный сжатый газ. Поэтому
следующая порция газа полойдег
дросселю более холодной. Пройдя
через дроссель, газ еще больше ох-
ладится, а возрлщаясь но внешней
грубе, еще сильнее охладит истреч-
иый газ Через некоторое время к
дросселю подойдет уже настолько хо-
лодный га.ч. что дросселирование при-
ведет к его сжижению, и в камере X
появится первая порция жидкости.
Теперь по широкой трубе будет ухо-
дить холодный пар Я он жидкости,
продолжая охлаждав встречный газ.
Холодную жидкость, скопившуюся
э холодильной камере, можно туг же
нспояыоиать для охлаждения других
тел. Иногда >тим «другим» телом слу-
жит соляной раствор, ы агоры и затем
поступает к грубам, проложенным н
.прилавках магазинов, под плогцад-
хон искусственного катка и т. д.
По можно поступить I-. иначе: сжи-
женный гая слить через крап В в спе-
циальные сосуды, пригодные для
хранения н транспортировки холод-
ных жидкостей (сосуды Дьюара). По-
лученную таким обраяом жидкость
можно использовать для охлаждения
других тел в любом месте и в любое
ьреыя. Обычно машины, в которых ох-
лажденный газ или жидкость исполь-
зуются как хладоагеит в холодиль-
ной камере, называются рефриже-
раторами. Машину же, предназначен-
ную для выдачи жидкого продукта,
называют ожнжнтельной машиной.
Дросселирование — наиболее часто
используемый способ охлаждения.
Оно, в частности, используется и в
домашних холодильниках.
Здесь необходимо сделать одно
существенное дополнение. Дело ц том,
чго дросселирование может приводить
17 Низкие температуры.
не только к охлаждению, но и к на-
греванию газа. И для каждого газа
существует определенная темпера-
тура, так называемая температура
инверсии эффекта Джоуля — Томсо-
на G,), выше которой происходит
именно нагревание. Это значит, что
если желательно охлаждать газ дрос-
селированием, то нужно позаботиться
о том, чтобы газ Выл предварительно
охлажден ниже температуры инвер-
сии. Для большинства газов, включая
азот и кислород, температура ин-
версии много выше комнатной, так
что никакие трудности не возникают.
Но у водорода и гелия она значитель-
но ниже обычных температур: у во-
дорода Т, равна 204° К, у гелия 40° К.
Следовательно, при сжижении этих
газов требуется их предварительное
охлаждение, прежде чем можно бу-
дет приступить к дросселированию.
Для этого можно использовать детан-
дерный способ. Во многих установках
для сжижения водорода и гелия ис-
пользуют сразу оба способа: в детан-
дере газ охлаждают ниже 7,; дальней-
шее охлаждение, вплоть до сжижения,
достигается дросселированием. Ком-
бинация этих методов применяется
при сжижении и других газов.
Еще ближе к абсолютному нулю
Описанные выше способы охлаж-
дения позволяют обратить в жидкость
любые газы, включая и гелий. Гелий
кипит при атмосферном давлении при
температуре 4,2 К- Интенсивно от-
качивая испаряющийся гелий с по-
мощью насоса, можно понизить дав-
ление паров над жидким гелием
и тем самым понизить температуру
кипения до 0,7° К. а если пользовать-
ся более легким изотопом гелия,
его температуру можно довести до
0,3° К. Более низкие температуры
получить таким способом нельзя.
Как же добраться до температур
в тысячные доли градуса?
Напомним, что понизить темпе-
ратуру — это значит уменьшить ту
часть беспорядка, которая зависит
от температуры. Для этого мы ис-
пользовали газ, у которого беспоря-
18
док велик. Но ведь при температурах,
близких к абсолютному нулю, сте-
пень беспорядка уже так мала, что
уменьшать ее очень трудно. При та-
ких температурах все вещества (кро-
ме гелия) твердые, так что рас-
считывать на адиабатное изменение
объема нельзя. Значит, надо найти
такие вещества, у которых даже при
этих температурах еще существует
беспорядок, зависящий не только от
температуры и объема. И такие веще-
ства физики нашли. Это некоторые
сложные парамагнитные вещества.
Парамагнитное вещество — это
вещество, содержащее частицы
(атомы, ионы, молекулы); кото-
рые ведут себя как маленькие магни-
тики. Из-за теплового движения эти
магнитики ориентированы совершен-
но беспорядочным образом. Правда,
при низких температурах, когда теп-
ловое движение очень ослаблено,
силы взаимодействия между магнити-
ками могли бы заставить их распо-
ложиться правильным образом.
Но если магнитики находятся на
значительных расстояниях один от
другого, то сил взаимодействия
не хватает на это, и магнитный
беспорядок сохраняется до самых
низких температур. Так обстоит
дело в очень сложных по составу
парамагнитных солях, в которых,
кроме магнитных частиц, есть много
других, немагнитных, например в соли
2Се (NO3)s.3Mg(NO3J-24H2O(церие-
во-магниевый нитрат). В этом веще-
стве «магнитиками» являются только
ионы церия Се. По на каждый ион
церия приходится около 60 других,
немагнитных атомов. «Магнитики» так
сильно «разбавлены» немагнитными
частицами, что беспорядок в ориен-
тациях ионов Се сохраняется даже
при температуре ниже 1°К. Вот и
нужное нам вещество: беспорядок в
нем велик и вблизи абсолютного нуля!
Беспорядок в парамагнитном веще-
стве может изменяться не только
при изменении его температуры, но и
при изменении его магнитного состоя-
ния. А магнитным состоянием вещества
можно управлять точно так же, как
18 Низкие температуры.
рис. г.
и объемом вещества. Это можно де-
лать с помощью магнитного поля.
Если парамагнитную соль поместить
в постоянное магнитное иоле, то вес
магнитики — ноны выстроятся парал-
лельно силовым линиям магнитного
поля. Мы наведем порядок в ориен-
тации нопуп. Убран поло, снопа соз-
дадим беспорядок. Это совершенно
аналогично сжатию п расширению
газа.
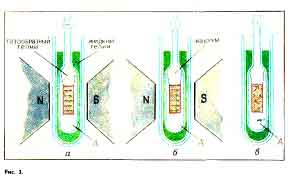
Для получения низки* температур
поступают следующим способом. Па-
рамагнитную соль в ампуле Л. ta-
полненнон газообразным гелием и на-
ходящейся в сосуде с жидким гели-
ем, температура которого «коло Г К.
помещают в магнитное поле между
полюсами злектромагннта (рис. 3, п).
Газообразный гелии в ампуле обес-
печивает тепловой контакт с жидким
гелием, так что температура намаг-
ниченной соли совпадает с темпера-
турой окружающего жидкого ге-
лия. Затем га.№оГ)ра.ч:н»ч»| гелии т
ампулы откачиваю!. уЭрспсчнв утны
теплоизоляцию соли oi окружающей
среды (рис. 3. б). После этого выклю-
чают магнитное поле, го есть произ-
водят адиа этнос размагничивание
соли fрис 3, п). При этом мринехо-
пазорпентаиин магнитиков —
попон, ч го должно привести к увеличе-
нию энтропии. А так как процесс раз-
магничивания аднабашын, то энтро-
пия в целом не может измениться и
соль охлаждается.
Описанным способом йот уже почти
сорок лет получают так называемые
сверхнизкие температуры, то есть
температуры ниже тех, что можно
получить с помощью только жидкого
гелия. Напшпнше температуры, полу-
чаемые таким образом, что тысячные
доли градуса.
Не только, атомы, но и атомные
ядра являются магнитиками, правда,
и КЮП раз более слабыми, [ice же.
если начать не с I К, a i» п.01 К.
можно адиабатным размагничиванием
уже и«- атомов, а ядер получить тем-
nepai\;iy около миллионной io.ii:
градус;). Но Ло уже тема для oi-
делыюп статьи
У п р я ж и и и is и
I П«ч-М\ ptiCilliiprliiK- (I .tt-iaiiJtvpi1 n
n i:>nii4-.ip
i4ii;;iTb
|
2. .Ч<)Ж1:1> .111 HP11 M.lllllllllOM
<*.\.l,l/h;b’ll)IH IlLllO.II.Wn.iTI. Ill-
a i|n |)|>r].\i;jl HIITlUJi’ lU-Uli-CIIl.i?
3. II K.ihiiч единицах измеряется энтро-
пия-1 Кльяя «iii- фи.ч1Ч(.ч-ь.1н De.iii’iiiiKi пзме-
ри> тся п r.iKiix единицах?
19 Низкие температуры.